Калькулятор молярности
Зная молекулярную массу вещества и молярность раствора можно рассчитать количество растворенного вещества и массовую долю растворенного вещества.
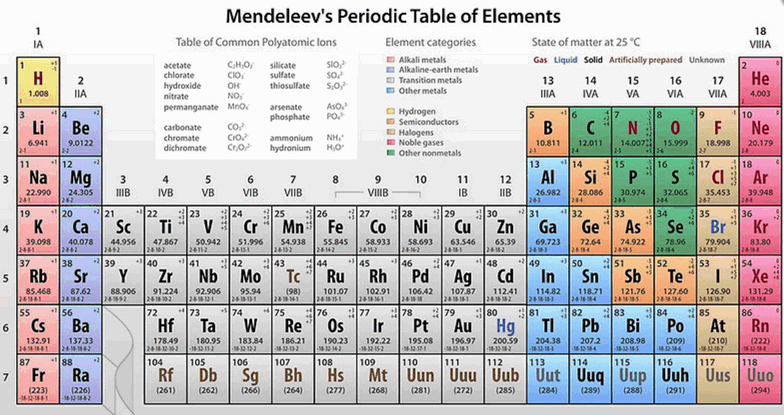
Массу атомов для вычисления молекулярной массы растворенного вещества можно посмотреть в таблице Менделеева в нижней части страницы (число под символом элемента)
В практических случаях молярность раствора приводят в кратных долях - милли, нано и пр.
![]() Здесь можно найти версию приложения для платформы Android
Здесь можно найти версию приложения для платформы Android
| Молярность | Название | Обозначение рус. | Обозначение англ. |
| 10-1 | деци | дM | dM |
| 10-2 | санти | сM | cM |
| 10-3 | милли | мM | mM |
| 10-6 | микро | мкM | μM |
| 10-9 | нано | нM | nM |
| 10-12 | пико | пM | pM |
Терминология
Моль - единица измерения количества вещества, устаревшее название – грамм-молекула. Моль является одной из семи основных единиц в системе СИ. Точная формулировка понятия "моль" такова:
Толковый словарь по медицине
МОЛЯРНОСТЬ — (molarity) концентрация раствора, выраженная через массу (в граммах) растворенного вещества,
содержащуюся в литре раствора, в отношении к его молекулярной массе
(по другому молярность это число молей, содержащееся в одном литре раствора)
МОЛЯЛЬНОСТЬ — (molality) число молей растворённого вещества в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности».
Так, раствор с концентрацией 0,5 моль/кг называют 0,5-моляльным.
Несмотря на сходство названий, молярная концентрация и моляльность - величины различные.
В отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя,
а не на объём раствора. Вследствие этого моляльность не зависит от температуры.
Моль есть количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц.
Количество специфицированных структурных элементов в одном моле вещества называется числом Авогадро. Число Авогадро приблизительно равно 6.022×1023 моль-1
Из сказанного выше следует, что молярная масса углерода-12 составляет 12 г/моль. Чтобы определить молярную массу какого либо вещества, следует посчитать его молекулярную массу, которая равна сумме масс атомов, входящих в состав данной молекулы. Это можно сделать, используя данные из наблицы Менделеева (внизу страницы) Например, у соли NaCl масса атома натрия равна 22.99, масса атома хлора - 35.453, итого молекулярная масса составляет приблизительно 22.99+35.45=58.44, и молярная масса, соответственно, 58.44 г/моль. Молярная масса необходима для расчета содержания веществ в растворах, концентрация которых задана в форме молярности раствора. Определение молярности дано во врезке.
Например, согласно определению, одномолярный раствор хлористого натрия NaCl это раствор, в 1 литре которого содержится 1 моль (а это, как мы уже подсчитали, 58.44 грамм) NaCl. Соответственно, 0.1-молярный раствор будет содержать в литре 5.844 г NaCl. Зачастую молярность обозначают как M – 1M – 1-молярный раствор, 0.1M – 0.1-молярный раствор, и тд.
На практике вам следует, используя приложение, рассчитать необходимую массу растворенного вещества, взвесить и затем растворить его в объеме растворителя,
чуть меньшем, чем требуемое количество раствора. Когда растворение завершено, доведите объем до нужного значения.
Например, вы хотите получить 450 мл 1М раствора NaCl в воде. Подставляем в приложении молекулярную массу 58.44, молярность 1 и объем 450 мл.
Приложение посчитает, что нужно 26.298 г соли. Наливаем приблизительно 400 мл воды, растворяем в ней 26.3 г соли и доводим объем до 450 мл.
Изначально растворяем в меньшем объеме растворителя, поскольку растворяемое вещество также занимает некоторый объем.
Другой случай. Вам необходимо приготовить 40 г 0.1-моляльного раствора NaCl. Из определения моляльности следует, что на 1 кг растворителя потребуется 5.844
NaCl. Допустим, на 40 г раствора потребуется Х грамм NaCl. Тогда растворителя потребуется (40-Х) грамм. Составим пропорцию и разрешим её относительно неизвестного Х.
Получаем Х=40*0.1*58.44/1000 = 0.2324. Следовательно, для получения 40 г 0.1-моляльного NaCl следует 0.2324 г соли растворить в 40-0.2324 = 39,7676 г растворителя.
Этот расчет вы можете провести в приложении для Андроид на вкладке "Моляльность"